编译:微科盟草重木雪,编辑:微科盟Tracy、江舜尧。
微科盟原创微文,欢迎转发转载。
论文ID
内容
1. 介绍
饮食几乎在癌症的所有方面都发挥着作用,包括肿瘤的发生、进展和对治疗的反应。例如,据估计,多达三分之一的最常见癌症是可以预防的,部分可通过饮食调整。这些关联是使用大规模基于人群的观察性队列研究建立的,这些研究提供了相关性的重要信息,但无法评估因果关系,并且难以准确记录饮食摄入量。临床前模型的控制、机制研究极大地提高了我们对组织如何利用营养物质以及饮食可能在肿瘤起始、进展和治疗反应中发挥作用的理解。这些研究表明,饮食可以为肿瘤提供可用于肿瘤生长的糖类和脂质等营养物质;调节促进肿瘤细胞增殖和存活的全身激素,如瘦素、胰岛素、胰岛素样生长因子1 (IGF1)和雌二醇;并支持肥胖的发展,从而创造了有利于肿瘤发生和进展的环境。由于饮食因素与肿瘤发生之间的联系已在其他地方得到很好的总结,我们在本次综述中的重点是饮食对肿瘤进展的影响以及这些信息如何转化为抗癌治疗。
我们正处于治疗癌症患者方式革命的边缘。Hopkins等人、Caffa等人和Maddocks等人对小鼠进行的临床前研究表明,饮食干预可以增强抗癌治疗并改善癌症预后。这些发现的转化正在进行中,早期临床数据支持其可行性和安全性。在接下来的5年内,我们将进行随机对照试验,以确定饮食对癌症患者临床结果的重要性。在这篇综述中,我们描述了肿瘤及其宿主组织的关键遗传和代谢特征,发现这些特征使肿瘤及宿主组织容易受到饮食干预的影响。我们评估该领域的状况,并就如何使精准营养成为癌症治疗方式提供建议。
2. 癌症的代谢弱点
2.1 营养素代谢的一般途径
细胞代谢的重编程是癌症的特征。转化细胞通过上调养分吸收和合成代谢过程来适应不受调节的细胞生长和增殖状态(图1)。糖、氨基酸和脂肪是支持癌细胞生长的基本膳食营养素。
葡萄糖是癌症生物学中研究最广泛的营养素,是细胞的主要能量来源,可从膳食碳水化合物的消化中获得,或通过肝脏或肾脏的合成代谢过程从头产生。一旦通过葡萄糖转运蛋白输入,葡萄糖可以通过两种主要方式在细胞中代谢。第一条也是最古老的途径是糖酵解。糖酵解发生在胞质溶胶中并分解葡萄糖以产生ATP,还原当量,例如NADH和丙酮酸。第二种是氧化磷酸化,利用还原当量氧化产生的能量在线粒体内膜上产生电动势,在此过程中还原和消耗氧气。与糖酵解相比,氧化磷酸化是每单位葡萄糖产生ATP的更有效方式,但在考虑每单位氧气时,其效率低于糖酵解。
绝大多数ATP来自糖酵解与氧化磷酸化的耦合,但这种联系在两种情况下受到干扰。首先是缺氧,此时氧气变得有限,氧化磷酸化的最终电子转移停止。缺氧细胞上调糖酵解以产生ATP并减少NADH的溢出。第二种情况发生在某些快速增殖的细胞中,例如T细胞、胚胎干细胞和肿瘤细胞。在这里,无论氧气水平如何,细胞通常都表现出高速率的糖酵解和乳酸发酵。长期以来,乳酸被认为只是糖酵解的废物,但现在被认为是人类肿瘤和健康组织的重要能量来源。在禁食小鼠中进行的稳定同位素示踪研究表明,乳酸在三羧酸 (TCA) 循环中间体中的掺入量超过了除大脑以外的所有组织中的葡萄糖量。
除了葡萄糖和乳酸外,果糖还在许多不同组织的代谢中发挥重要作用。虽然小肠和肝脏的膳食果糖浓度最高,但食用果糖后血清果糖显著升高,并被肾脏、前列腺和骨髓等组织代谢。在细胞内,果糖可以被裂解成糖酵解中间体并被氧化以产生能量。尽管使用了许多类似的葡萄糖途径,但果糖代谢受到独特的调节,通常会导致不同的下游终点。对小鼠的研究表明,果糖可以重新编程合成代谢和细胞存活的代谢途径,这一作用可能在实体瘤中特别重要。
其他营养成分如氨基酸是合成代谢过程的组成部分。谷氨酰胺是一种来自膳食来源、肌肉降解或从头合成途径的非必需氨基酸。通过转化为α-酮戊二酸,谷氨酰胺为TCA循环中间体提供碳,然后可以将其用于各种合成代谢过程,例如脂肪酸的合成。不同于谷氨酰胺,支链氨基酸(BCAA)(亮氨酸、异亮氨酸和缬氨酸)是主要从膳食来源获得的必需氨基酸。对小鼠的研究表明,这些物质可以被许多组织和肿瘤吸收,并被整合到新合成的蛋白质中或被氧化作为原料。
脂肪酸是一种密集的能量来源,可以从饮食中获得并以甘油三酯的形式储存在体内。在食物摄入量低的时候,哺乳动物分解代谢甘油三酯并释放产生的脂肪酸和甘油。甘油可以被细胞用作糖酵解、糖异生或脂肪生成底物。脂肪酸可以被氧化生成ATP,再用于合成其他脂质部分,如磷脂和胆固醇酯,或储存在细胞内的脂滴中。当被肝脏氧化时,脂肪酸会产生酮体,这些酮体被释放到循环中并在某些组织中进入TCA循环。这些过程在快速增殖的组织(如肿瘤)中经常被上调。
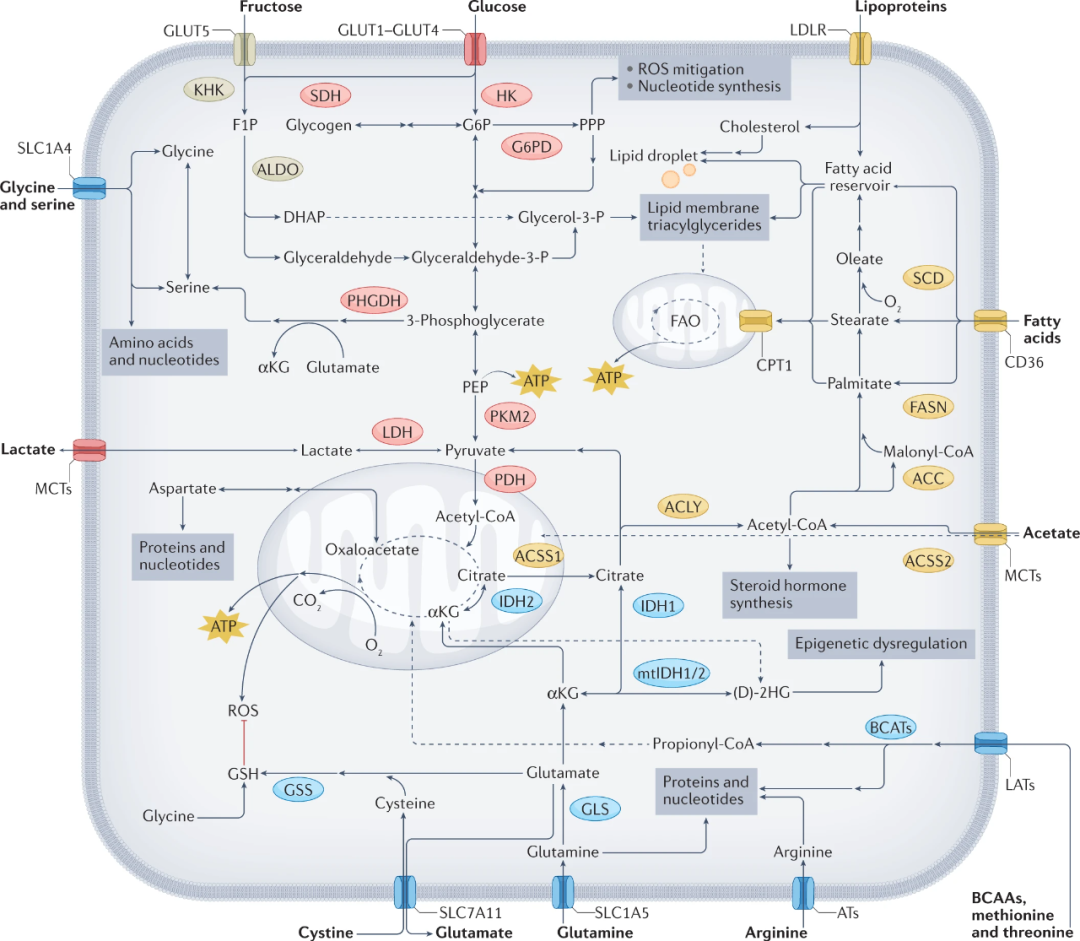
图1 癌症中的营养利用
多种途径介导细胞外糖、脂肪和氨基酸转化为能量或合成代谢过程的组成部分。图中显示了在这些途径中对癌症至关重要和/或经常上调的酶,根据它们的主要营养关联进行颜色编码:果糖(米色)、葡萄糖(粉红色)、脂质摄取和降解(黄色)和氨基酸代谢(蓝色)。ACC,乙酰辅酶A羧化酶;ACLY,ATP柠檬酸裂解酶;ACSS,乙酰辅酶A合成酶;ALDO,醛缩酶;ATs,精氨酸转运蛋白;BCAAs,支链氨基酸;BCATs,支链氨基酸转氨酶;CPT1,肉碱棕榈酰转移酶I;FAO,脂肪酸氧化;FASN,脂肪酸合酶;G6PD,葡萄糖-6-磷酸脱氢酶;GLS,谷氨酰胺酶;GLUT,葡萄糖转运蛋白;GSS,谷胱甘肽合成酶;(mt)IDH,(突变的)异柠檬酸脱氢酶;KHK,酮己糖激酶;LATs,L型氨基酸转运蛋白;LDH,乳酸脱氢酶;LDLR,低密度脂蛋白受体;MCT,单羧化酶转运蛋白;PDH,丙酮酸脱氢酶;PHGDH,磷酸甘油酸脱氢酶;PKM2,丙酮酸激酶异构体M2;PPP,戊糖-磷酸途径;SCD,硬脂酰辅酶A去饱和酶;SDH,山梨糖醇脱氢酶;SLC1A4,溶质载体家族1成员4;SLC1A5,溶质载体家族1成员5;SLC7A11,溶质载体家族7成员11。
2.2 组织特异性代谢
癌细胞根据其组织来源、遗传改变以及与全身激素和代谢物的相互作用程度而获得不同的代谢偏好。由于对糖、脂肪和氨基酸的根深蒂固的、谱系依赖的偏好,起源组织对肿瘤中的代谢物丰度和代谢基因表达具有特别强烈的影响(图2)。为了简单起见,这篇综述关注在一些高恶性转化倾向组织上的代谢,并且已有较多文献报道它们与膳食营养的关系。对于感兴趣的读者,目前已经有很好的综述,总结了饮食和肿瘤代谢在其他癌症类型中的关系,例如胃癌和肾癌。
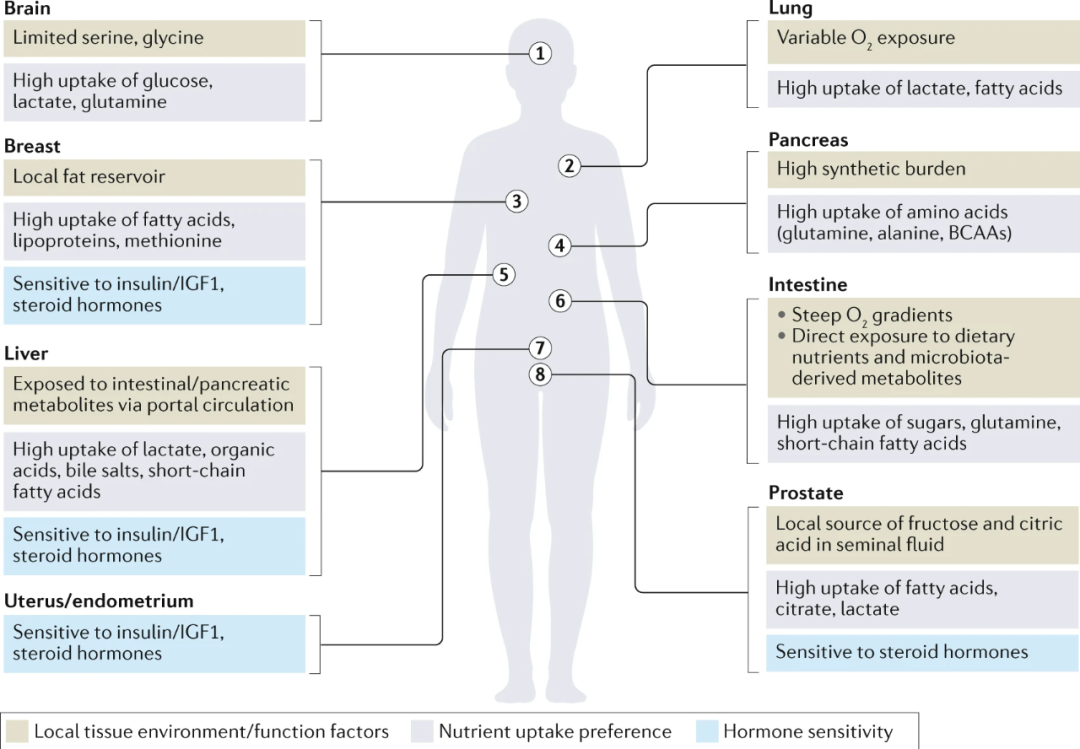
图2 组织特异性代谢
各种组织的显著代谢特征。这些组织的解剖位置以及它们正常功能的代谢需求可能会带来可以通过饮食和/或药物疗法靶向的脆弱性。相关参考见正文。BCAAs,支链氨基酸;IGF1,胰岛素样生长因子1。
2.2.1 脑
大脑是一个独特的器官,它依赖于葡萄糖和/或酮体的摄取和氧化,并且通过选择性渗透的血脑屏障与全身循环分离。高葡萄糖利用部分是由编码转运蛋白溶质载体家族2成员3 (SLC2A3)的基因表达驱动的,该基因对葡萄糖具有高亲和力和转运能力。小鼠研究表明,大脑不同区域的葡萄糖摄取存在明显的异质性。此外,包括小鼠和人类示踪成像研究在内的大量证据表明,神经元可能更喜欢使用局部星形胶质细胞产生的乳酸作为主要原料。小鼠和大鼠研究表明,大脑也能够在禁食期间代谢酮体,尽管摄取和使用在空间上也是异质的。与此同时,神经元细胞很少使用脂肪酸来满足能量需求。同样,谷氨酰胺等氨基酸也很少被脑细胞氧化。谷氨酸是一种兴奋性神经递质,如果积累会引起神经毒性,因此它会被星形胶质细胞迅速转化为谷氨酰胺,然后再转运回神经元。
原发性脑肿瘤通过代谢适应生长和存活。例如,许多脑肿瘤表达更高水平或不同亚型的糖酵解酶(例如,己糖激酶、丙酮酸激酶、丙酮酸脱氢酶(PDH)),这为它们在大脑独特的环境中提供了特定的优势。这些独特特征中的一些可用于治疗或诊断。例如,体外研究表明,剥夺脑肿瘤的葡萄糖可能是一种有用的治疗策略,因为正常的神经元能够在酮体上存活,但神经胶质瘤细胞则不行。一部分特别具有侵袭性的脑肿瘤通过下调线粒体丙酮酸转运蛋白亚基MPC1来促进糖酵解,这使得细胞依赖于体外谷氨酰胺的摄取。70%的中级别胶质瘤发生异柠檬酸脱氢酶(IDH1或IDH2)突变,并影响胶质瘤对营养缺乏的敏感性;体外追踪研究表明,这些肿瘤特别依赖谷氨酰胺(图1)。
营养供应似乎也影响脑内转移性肿瘤的生长。例如,与血清相比,大脑中丝氨酸和脂肪酸的可用性相对较低,而小鼠模型表明,乳腺癌脑转移增加了对这些成分从头生成的依赖。此外,对切除的人类肿瘤的核磁共振(NMR)标记研究表明,来自各种原发部位的转移灶在到达大脑时可以获得将氧化乙酸盐作为原料来源的能力。
2.2.2 乳腺
乳腺组织内的乳腺具有很强的合成大量大分子的能力,这些大分子会输出到乳汁中。该过程的底物来源于饮食,包括葡萄糖、脂肪酸、脂蛋白和氨基酸(尤其是蛋氨酸)。乳房的大部分营养吸收受胰岛素、IGF1和类固醇激素(如雌激素和黄体酮)的调节。例如,人乳腺组织中氟脱氧葡萄糖(FDG)的摄取随着孕酮水平的增加而增加,而脂质和蛋白质的摄取和产生受到胰岛素的显著调节。
乳腺中与激素感应和营养吸收有关的通路失调会促进癌症的发展。例如,PI3K通路通常在人类乳腺肿瘤中通过主要催化亚基PIK3CA的基因突变而被过度激活。PI3K是一种脂质激酶,可响应胰岛素和IGF1等环境生长信号以促进增殖和营养吸收。对患者来源细胞系的研究表明,PI3K的过度活化是雌激素受体(ER)阳性肿瘤逃避激素治疗的一种方式。相应地,来自用PI3K抑制剂处理的小鼠模型和人类的数据表明,肿瘤上调ER信号作为一种逃避策略。这些发现促使临床医生开始同时靶向PI3K和ER,这种方法在一些乳腺癌患者中被证明是有效的。
乳腺肿瘤的分子特征影响营养吸收和代谢。人体影像学研究证实了临床前模型,表明ER阳性肿瘤具有相对氧化性并消耗乳酸和柠檬酸盐,而三阴性乳腺肿瘤会释放更多的糖酵解乳酸。雌激素相关受体(ERR)的表达,即与ER结构相似的孤儿核受体,也可以改变乳腺肿瘤的代谢。例如,人类基因组研究和体外模型表明,ERRα活性促进了多种代谢酶的表达,并表现出了预后较差的侵袭性糖酵解表型。人类基因组研究和异种移植小鼠模型也表明,三阴性乳腺肿瘤依赖于丝氨酸的从头合成,这在肿瘤微环境中是有限的,可以通过饮食进一步消耗。
脂肪酸代谢对某些分子亚型乳腺癌的发展也很重要。例如,与健康女性的乳腺组织相比,后来患癌症的女性正常组织显示出脂肪酸摄取和转运、脂肪分解、脂质过氧化和上皮-脂肪组织串扰上调。外源性脂肪酸的摄取预示着较差的预后,并且是侵袭性三阴性肿瘤的典型特征。脂肪酸代谢也可能在乳腺的局部脂肪沉积中受到干扰。体外共培养研究表明,脂肪细胞可以将脂肪酸输送到肿瘤细胞并诱导基因表达变化,从而增强肿瘤细胞的迁移。脂肪细胞也通过芳香酶产生雌激素,这可以解释为什么良性人类乳腺组织和肿瘤中的雌激素水平比血清中高得多。
2.2.3 子宫内膜
与乳房类似,子宫内膜是一种激素反应性组织,代谢需求波动很大。对小鼠和人类子宫内膜基质细胞的研究表明,葡萄糖转运蛋白的表达和葡萄糖摄取受孕酮的正向调节,而受雌激素的负向调节。此外,胰岛素会刺激子宫内膜黏膜的生长,尤其是在IGF1信号传导必不可少的子宫内膜周期的增殖阶段。在小鼠模型中,PI3K通路的细胞自主激活足以引发子宫内膜肿瘤,而PI3K通路在人类子宫内膜癌中经常被激活。超过90%的人类子宫内膜肿瘤的PI3K信号通路发生遗传改变,通常是通过激活PIK3CA中的突变或PTEN(编码直接拮抗PI3K的磷酸酶的基因)中的功能丧失突变。这些变化可能是子宫内膜癌与高胰岛素血症生物标志物临床关联的基础,例如空腹血糖、胰岛素、c肽(胰岛素产生)、血红蛋白A1C(慢性高血糖)和饮食血糖负荷。
2.2.4 前列腺
与乳腺和子宫内膜一样,前列腺对性激素高度敏感。特别是,睾酮驱动葡萄糖摄取,这可以通过FDG-PET检测到,并在大鼠中通过雌激素给药逆转。体外和小鼠模型还表明,睾酮显著加速了氨基酸与蛋白质的结合,以及乙酸盐与脂肪酸和柠檬酸的结合。这些变化有助于支持前列腺产生精液的主要生物合成作用,精液中富含由特殊上皮细胞产生的柠檬酸和水解酶。这些细胞是高度糖酵解的,氧化磷酸化能力减弱,使它们能够产生和释放柠檬酸盐。精液中也富含果糖,对人体组织的研究表明,这种果糖是葡萄糖通过多元醇途径从头产生的。该途径使用醛糖还原酶将葡萄糖还原为山梨糖醇,然后使用山梨糖醇脱氢酶(SDH)将山梨糖醇氧化为果糖(图1)。SDH是一种雄激素调节基因,除了精囊外,它还在良性和恶性人类前列腺癌中表达。
与大多数其他肿瘤类型一样,癌变会增加前列腺癌的营养吸收和利用。小鼠和人体组织研究表明,前列腺癌细胞在转化过程中恢复了进行氧化磷酸化的能力。这种适应使这些肿瘤很容易消耗和氧化局部产生的营养物质,如柠檬酸盐和乳酸。此外,新出现的证据表明,果糖可能是前列腺癌细胞的关键底物。例如,人类原发性前列腺肿瘤高表达SLC2A5,即主要的果糖转运蛋白。果糖可能来自饮食来源,或者肿瘤可能在精囊侵袭期间获得果糖密集的液体,这使人类的预后甚至比其他局部侵袭更差。脂肪酸对前列腺癌也很重要,因为抑制它们的摄取会减缓小鼠模型中的肿瘤进展。
2.2.5 肺
健康猪的稳定同位素标记研究表明,肺代谢因羟基丁酸和乙酰乙酸(酮体)、谷氨酰胺和饱和脂肪酸的消耗量相对较高而显著。肺中的营养摄取对全身激素并不特别敏感。例如,与其他组织相比,禁食和再进食时葡萄糖和乳酸对TCA循环中间体的贡献变化很小。
肺是一个很好的例子,它的局部效应可能会改变肿瘤的代谢表型。与许多其他肿瘤一样,原发性肺肿瘤的突变发生在与葡萄糖摄取增加和流向合成代谢途径相关的通路中。这些突变包括表皮生长因子受体 (EGFR)-PI3K通路中的基因、KRAS和MYC等致癌基因以及STK11等肿瘤抑制基因。然而,与其他组织中遗传相似的肿瘤相比,具有这些改变的肺肿瘤通常具有不同的代谢表型。这种区别可能是由于肺部环境的独特特征,它为原发性和转移性肿瘤提供了一系列代谢优势。例如,小鼠模型研究表明,肺环境可能更好地允许丙酮酸和脯氨酸代谢,从而优先支持乳腺癌转移。另一个例子来自人体稳定同位素追踪研究,该研究发现非小细胞肺癌(NSCLC)肿瘤保持高水平的葡萄糖氧化,并且可以使用多种TCA底物,可能包括乳酸。在这项研究中,肿瘤之间和肿瘤内的肿瘤代谢高度异质,这表明同一组织内肿瘤环境的变化也会改变代谢。最后一个关于肿瘤部位改变代谢表型的例子来自于对老鼠的研究,结果表明KRAS突变胰腺肿瘤通过巨胞饮作用显著清除其微环境中的营养物质,但KRAS突变的NSCLC肿瘤的摄取量相对较少,即使来自同一生物体也是如此。
肺肿瘤的一些代谢特征可能被证明是代谢弱点。例如,人类肺肿瘤相对于正常肺组织表达高水平的果糖分解酶,抑制果糖摄取会减少异种移植模型中的肿瘤生长。一些临床前KRAS驱动的肿瘤研究中也报道了谷氨酰胺依赖性,携带KRAS-G12V的细胞对谷氨酰胺的依赖性低于表达KRAS-G12(C/D)的细胞。然而,在小鼠模型中的其他研究表明,当葡萄糖存在时,谷氨酰胺代谢对于促进TCA循环是可有可无的。KRAS突变的肿瘤也可能对靶向BCAA和脂肪酸代谢的疗法敏感。与正常肺相比,NSCLC肿瘤中的BCAA摄取升高,这与临床疾病早期的低血清水平一致,并且BCAA转运蛋白的缺失会损害小鼠的肿瘤形成。脂肪酸代谢也可能是一个潜在靶点,至少存在一种酶,即酰基辅酶A合成酶长链家族成员3 (ACSL3),在人类NSCLC中高度表达,对小鼠中KRAS突变肺癌的肿瘤发生至关重要。
2.2.6 胰腺
胰腺的主要作用是合成代谢:合成和分泌激素和酶。这个过程需要大量的氨基酸,它们既是蛋白质合成的组成成分,也是三羧酸循环依赖性氨基酸产生的原料。在小鼠和猪的11个器官中,胰腺显示出对氨基酸的最大利用能力。这些氨基酸被产生酶原的腺泡细胞消耗和重新利用。
尽管胰腺是主要的内分泌器官并且暴露于高水平的胰岛素,但它吸收营养物质对全身激素并不特别敏感。事实上,胰岛素介导的葡萄糖摄取对小鼠胰腺中的TCA中间体几乎没有影响。脂肪酸和酮体在禁食期间等更容易被利用。尽管有这些发现,但全身性胰岛素已被证明可以促进小鼠胰腺癌前病变的形成。这些数据表明,胰岛素在胰腺肿瘤发生中的作用可能与其刺激葡萄糖摄取的能力无关。
KRAS突变在人类胰腺导管腺癌(PDAC)中很常见,这些肿瘤具有几个熟悉且独特的代谢特征,这些特征可能被证明是可靶向的弱点。例如,体外标记和小鼠肿瘤遗传分析表明,在这些肿瘤中,葡萄糖摄取、经糖酵解和碳转移进入氨基己糖和磷酸戊糖途径的通量增加。然而,在KRAS驱动的PDAC细胞和小鼠模型中的研究表明,这些肿瘤通过非典型酶途径增加了对谷氨酰胺anapleurosis的依赖。一个明显的例外是肿瘤的代谢偏好与其组织起源相同,相对于小鼠的正常胰腺,PDAC中的BCAA消耗量减少。如上所述,体外和小鼠研究表明,与KRAS驱动的肺肿瘤相比,KRAS驱动的PDAC细胞依赖于通过巨胞饮作用清除细胞外氨基酸。小鼠模型和流行病学数据也表明,从血清中摄取脂肪酸是胰腺中PDAC和癌前细胞的一个重要特征。例如,体外脂质标记研究以及小鼠肿瘤的基因表达分析表明,RAS转化的胰腺细胞会大量消耗其环境中的不饱和脂肪酸,可能可以作为一种规避缺氧诱导的硬脂酰辅酶A去饱和酶(SCD)抑制的方法。饮食干预限制不饱和脂肪酸可用性,减缓了携带PDAC同种异体移植物小鼠的肿瘤生长,并且可能是人类可行的治疗选择。
2.2.7 肠
根据食物摄入量和肠道菌群的活动,肠道上皮细胞会受到营养物质的巨大周期性波动的影响。传统上,肠道主要被视为膳食营养素的转运体,但最近的研究强调了它在代谢中更积极的作用。例如,小鼠肠上皮将低剂量的膳食果糖转化为葡萄糖和有机酸,随后输送到门静脉血和肝脏。对小鼠和猪的体内标记研究还表明,肠道是人体产生丙酸、丁酸和乙酸等短链脂肪酸的主要场所,这些脂肪酸主要由肠道微生物群产生。除了为身体生产营养外,肠道还消耗循环营养素,如葡萄糖和谷氨酰胺。小鼠和猪的标记研究还表明,小肠是进食状态下葡萄糖处理和禁食时酮体氧化的主要场所之一。
结直肠癌(CRC)是最常见的源自肠道的癌症,其代谢反映了引起的突变、营养可用性,以及组织来源情况。大多数CRCs源于WNT、PI3K和KRAS通路的散发突变。WNT信号在93%的CRC肿瘤中过度活跃,并且在体外研究、小鼠异种移植模型和人类肿瘤样本中与氧化代谢受损、戊糖磷酸途径(PPP)通量增加和脂肪酸合成增加有关。PI3K通路突变依赖于谷氨酰胺摄取和代谢,被有效靶向后可减少小鼠模型中的肿瘤生长。KRAS突变在人CRC衍生细胞系和小鼠异种移植肿瘤的低葡萄糖条件下增强葡萄糖转运蛋白表达和改善细胞存活率。新出现的证据表明,结直肠癌肿瘤还可以直接运输和代谢饮食中的果糖:摄入适量的果糖可通过放大缺氧反应基因的表达来促进小鼠肠道肿瘤的生长。果糖对肿瘤生长的影响可以通过靶向果糖分解酶、酮己糖激酶(KHK)或糖酵解酶丙酮酸激酶异构体M2 (PKM2)来消除,后者在介导缺氧信号传导中起关键作用。
2.2.8 肝
胰腺和肠道流入静脉血池,由肝脏直接过滤和取样。这种独特的解剖学结构使肝脏成为营养丰富和生长因子丰富的环境,非常适合转移性生长和肿瘤发生。例如,与其他组织相比,肝脏接受源于小肠的高水平果糖、乳酸和有机酸,以及源于胰腺的胰岛素。肝脏对激素也很敏感,随着时间的推移对小鼠肝脏转录谱的研究表明,各种代谢物的高摄取率和产生率取决于循环激素以及细胞内在的昼夜节律信号。例如,猪的稳定同位素标记研究表明,肝脏吸收循环脂肪酸(主要是不饱和脂肪酸)、氨基酸和乳酸,并释放谷氨酸和酮体,以响应禁食引起的低胰岛素和高胰高血糖素状态。肝脏也是少数能够通过糖异生产生和释放葡萄糖的组织之一,是禁食小鼠循环葡萄糖的主要来源。
肝细胞癌(HCC)是肝脏最常见的原发性肿瘤,其发生发展与营养摄入和全身代谢密切相关。HCC通常是从慢性病肝组织逐渐演变而来的,例如在非酒精性脂肪性肝病(NAFLD)的情况下,据估计该病会影响全球多达三分之一的成年人口。因此,研究者们对导致NAFLD发展及其进展为HCC的全身和局部代谢改变给予了很多关注。例如,过去二十年的流行病学研究表明,肥胖和代谢综合征会增加NAFLD的风险及其进展为HCC。与肥胖相关的饮食,例如高脂肪和高果糖饮食,也会在化学诱导的小鼠模型中促进HCC。从机制上讲,从头脂肪生成(DNL)据称在从NAFLD到HCC的进展中起重要作用。尽管有一种理论认为肝细胞摄取和脂质生成增加导致了慢性肝炎症的发生,从而选择了HCC祖细胞,但目前我们还不确定将DNL和HCC联系起来的确切事件顺序。事实上,最近的一项研究表明,从头脂肪生成酶乙酰辅酶A羧化酶(ACC)中具有激活突变的大鼠在喂食高果糖饮食时,表现出增加的肝癌变和肿瘤细胞增殖。此外,一种ACC抑制剂有效地减少了大鼠和人类肿瘤衍生细胞系中的肿瘤增殖。HCC用于脂肪生成的一种底物是葡萄糖,与其他癌症类似,HCC通常会上调糖酵解,尽管人类影像学研究表明葡萄糖摄取是高度可变的,并且某些肿瘤更喜欢使用替代的营养来源,例如乙酸盐。
2.3 微生物组
除了在其他肿瘤背景下研究的典型常量营养素外,肠道和肝脏对饮食、微生物和胃肠道分泌产物有独特的影响,必须加以考虑。例如,小鼠研究表明,高脂肪饮食可以促进肠道中的菌群种类,从而使可促肿瘤发展的胆汁酸种类数量增加。对无菌小鼠与传统饲养小鼠的其他研究表明,由肠道中膳食碳水化合物的微生物代谢产生的短链脂肪酸丁酸盐是分化的结肠细胞的主要能量来源。虽然丁酸盐的产生可以通过饮食干预来调节,但此类干预是否是CRC的理想疗法,目前小鼠相关研究的结论尚不一致,需要后续进一步研究确定。微生物短链脂肪酸也是肝脏的重要底物。例如,最近对小鼠的追踪研究表明,部分膳食果糖,经肠道内微生物群转化为乙酸盐,从而成为肝脏脂肪生成的信号和底物。人类HCCs的全局基因表达谱分析还发现了一些侵袭性肿瘤,这些肿瘤可能依赖肠道来源的乙酸盐进行脂肪酸合成,为饮食和/或微生物干预提供了前景。除了这些微生物影响肿瘤营养供应的例子之外,还有大量的临床前模型研究报告了微生物组与癌症发生、生长和对治疗的反应之间的关联,这些研究在其他地方的综述中都有介绍。由于微生物组的元素明显受到饮食的影响,因此微生物组与癌症之间的这种机制关联为人类研究中的饮食干预提供了潜在的靶点。
3. 饮食疗法的系统性影响
饮食干预可能会以多种方式改善肿瘤治疗。例如,饮食可以消除肿瘤用作原料的特定营养素。它们还可以通过剥夺肿瘤逃逸的营养和信号来增强其他形式的疗效,例如放疗(方框1)和化疗。饮食也可以起到次要作用,调节生长因子的丰度或改变全身免疫状态,分别影响肿瘤生长和抗肿瘤免疫反应。
饮食干预有多种形式。一些关注含量,例如能量(热量)限制或大量营养素操作,而其他则由时间定义,例如间歇性禁食方案,无论膳食成分如何,都给予完全或部分能量限制的间隔。由于这些干预措施长期以来一直用于肥胖和糖尿病领域,我们对这些研究进行了简要回顾,以帮助确定癌症患者可能发生的潜在有益代谢反应。例如,对肥胖受试者的研究表明,任何热量缺乏的饮食干预都会激活神经激素反应,导致体重减轻、胰岛素和瘦素水平降低、脂肪组织中脂肪分解的激活以及血糖变异性降低。
框1 辅助放射治疗的饮食干预
3.1 热量限制
热量限制可减少每日总能量摄入,同时保持均衡的常量营养素比例。在大多数临床应用中,受试者的热量摄入减少了15-30%。这种热量限制会降低超重成人的体重、脂肪量、胰岛素、甲状腺激素和代谢率。这些发现在干预后的6个月和2年仍然存在,并且也发生在已有代谢障碍的肥胖受试者中。在热量限制的研究中,当参与者可自由饮食且积极性很高时,退出率可以达到30% - 40%。卡路里限制通常具有良好的耐受性,几乎没有意外的不良事件。
自1900年代初以来,研究人员已经观察到限制卡路里在小鼠肿瘤模型中的有益作用。除了降低小鼠的肿瘤发病率外,热量限制还能减缓癌症的进展和转移的发生率。例如,热量限制提供了更好的保护,以防止乳腺和肠道肿瘤的生长和转移。热量限制改善肿瘤预后的机制是多方面的。热量限制会降低胰岛素,从而降低肿瘤PI3K信号传导。热量限制还能促进免疫信号的有益变化,激活抗氧化途径,并减少循环中的不饱和脂肪。
目前在人类中描述卡路里限制作为抗癌干预措施的影响研究较少。短期研究表明,它不会增加化疗期间的3级或4级不良事件,表明热量限制是安全的。2007年,研究者启动了一项III期试验,以测试热量限制和运动(作为糖尿病预防计划管理)对绝经后乳腺癌妇女的无病生存期和总生存期的影响。不幸的是,由于资金损失,研究项目提前终止,计划中的2,150名妇女中只有338人参加。现有数据显示2年内体重减轻小幅(约4%)但显著,退出率仅为22%,并且有改善无病生存率的趋势(风险比0.71,95%置信区间0.41-1.24,P = 0.23)。因此,我们热切期待乳腺癌减肥研究(BWEL研究)的结果,这是一项评估热量限制作为早期乳腺癌辅助治疗的随机III期试验。
3.2 禁食模拟饮食
在热量限制干预期间,两餐之间的禁食时间是一个通常被忽略的混杂变量。接受卡路里限制的小鼠会将食物摄入量集中到一顿饭中,导致间歇性的大量热量流入,间隔着长时间的禁食和多动。这种适应导致一些人质疑是卡路里限制本身还是禁食期介导了小鼠模型中卡路里限制的益处。在对小鼠进行的严格对照研究中,将卡路里限制与每天一餐提供正常卡路里量的禁食干预进行了比较,无论卡路里摄入量、饮食成分和体重如何,禁食对健康和生存有类似的改善。
在接受化疗的癌症受试者的小型临床研究中,禁食降低了促肿瘤激素,减少了不良事件并提高了生活质量。禁食还会改变外周免疫细胞的丰度,例如单核细胞和树突状细胞亚群,这可能具有抗肿瘤作用。然而,长时间的禁食很难维持。因此,研究者们已经设计了几种间歇性禁食方案来模拟禁食的好处并提高长期依从性。一个这样的计划是禁食模拟饮食(FMD),受试者每个月连续四天或五天进行卡路里限制、低碳水化合物、低蛋白饮食的循环。例如,FMD可能包括为期5天的植物性饮食,第1天最多600卡路里,第2-5天最多300卡路里。在本月剩余的时间里,食物不受限制,因此参与者在FMD周期之间有很长的休息时间。在一项针对100名健康受试者的随机交叉研究中,与标准饮食相比,3个FMD周期可减轻体重和总体脂肪、降低血压、降低血胰岛素和IGF1水平。干预是安全的,没有3级或4级不良事件,退出率(25%)优于卡路里限制干预试验。在一项针对60名肥胖女性的随机对照试验中,将卡路里限制与热量限制进行了直接比较,2个月的FMD导致类似的体重减轻和胰岛素抵抗和肌肉质量标志物的改善,尽管这些不是使用金标准方法测量的。其他形式的间歇性禁食,例如限时进食,正在研究中(框2)。
框2 限时饮食
在癌症小鼠模型中,禁食周期会减少肿瘤发生并减缓肿瘤生长。当与传统的抗癌疗法相结合时,FMD周期可以提高治疗效果。例如,禁食周期提高了吉西他滨对前列腺癌异种移植小鼠的疗效,FMD策略与抗雌激素治疗和细胞周期蛋白依赖性激酶4 (CDK4)和CDK6 (以下称为CDK4/6)抑制相结合,可导致小鼠乳腺肿瘤的持久缓解,这是一种临床相关的组合。FMD的有益作用取决于低水平的胰岛素、瘦素和IGF1;当这些激素与接受FMD的小鼠共同处理时,饮食的抗肿瘤作用就会消失。
FMD是一种很有前景的临床干预措施,正在沿着临床开发流程快速推进(图3)。在大多数情况下,FMD是安全和可行的,癌症受试者在3个FMD周期后3级或4级不良事件发生率为13%,退出率为24%。在小鼠中观察到的对胰岛素、IGF1和瘦素的有益代谢作用似乎在患有癌症的受试者中保持不变,同时保持体重。这些变化降低了免疫抑制性外周细胞并增强了肿瘤内的细胞毒性反应。此外,FMD与CDK4/6抑制剂联合使用是安全的,并且可以提高疗效。我们热切地等待更多具有正式肿瘤结果的临床研究。
3.3 极低碳水化合物(生酮)饮食
卡路里限制和禁食的一些系统代谢益处可以通过改变常量营养素比例的饮食来重现。例如,与标准饮食相比,极低碳水化合物饮食(VLCD)或低脂肪饮食(LFD)会抑制食物摄入并改变致瘤激素。这些饮食已在癌症患者中进行了数十年的研究,显示出足够的安全性、可行性,在某些情况下,还显示出抗癌功效数据。
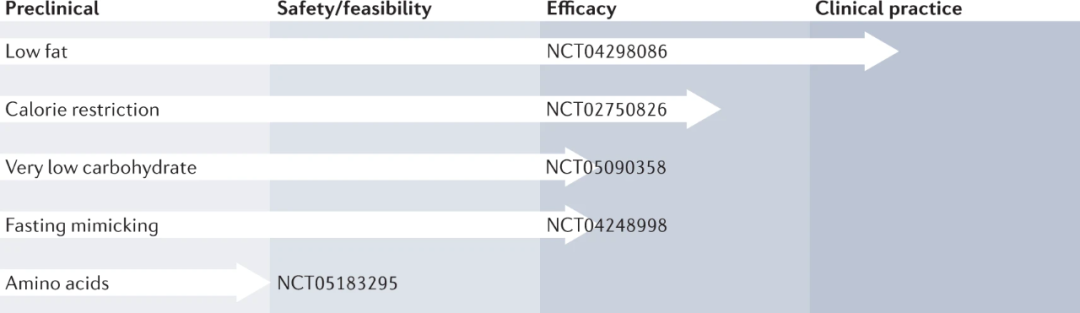
图3 癌症饮食干预的发展进展
一些饮食干预措施在临床开发过程中进展顺利,并强调了具体的示例试验。基于主要针对乳腺癌患者的证据,低脂饮食(LFD)经常被推荐给癌症患者。卡路里限制对癌症患者是安全的,但高退出率和资金不足限制了正式的疗效研究。极低碳水化合物饮食(VLCD)和模拟禁食饮食(FMD)正在通过安全性和可行性研究迅速推进,并且针对癌症受试者的疗效试验即将到来。限时饮食和缺乏特定氨基酸的饮食已在小鼠模型中显示出疗效,但可获得的临床数据有限。
VLCD在1920年代被临床描述为维持禁食缓解癫痫作用的一种手段。在这种“经典”形式中,VLCD的碳水化合物摄入量非常低,每天≤15 克(<5% 的卡路里),适中或低的蛋白质摄入量和足够的脂肪来弥补其余的卡路里消耗。通常,脂肪来自椰子油、黄油、鸡蛋、牛油果、奶酪和肉类。这种饮食方式已被证明可以促进和维持癫痫儿童、肥胖伴代谢综合征的成人和癌症患者的血清胰岛素水平很低。由于缺乏碳水化合物和血糖负荷,与LFDs相比,VLCDs在改善高体重指数患者(尤其是已患有糖尿病的患者)中与血糖、体重和血脂控制相关的代谢参数方面更有效。
目前研究者尚未在大型、前瞻性、随机对照临床试验中评估VLCD的长期影响;但是,有安全性的支持性证据。在一项针对2年以上2型糖尿病参与者的非随机研究中,一项包括远程医疗、健康指导和个性化VLCD在内的干预措施改善了代谢指标,没有报告不良事件,退出率为26%。在没有肥胖或代谢疾病的患者中,饮食可能会在最初几天到几周内引起轻度疲劳、头痛、恶心、便秘、低血糖和酸中毒。研究者在老年人中报告了低度脱水、肝炎、胰腺炎、高甘油三酯血症、高尿酸血症、高胆固醇血症、低镁血症和低钠血症。
尽管可能发生不良事件,一个对13项在各种癌症患者中使用VLCD的研究的系统评价得出的结论是,这种方法是安全的,尤其是与传统的抗癌疗法相比时。例如,Cohen等人对患有卵巢癌或子宫癌的女性进行了为期12周的随机对照试验,以测试VLCD干预对代谢参数的影响。受试者对饮食的依从性非常好(退出率19%),并且只有低级别的不良事件,包括饥饿、便秘、疲劳、肌肉痉挛、腹泻和四肢发冷。受试者表现出选择性的脂肪质量下降,瘦肉质量不变,血脂没有变化。那些使用VLCD的人胰岛素产生量显著降低,身体机能得分更高。该队列未报告对肿瘤结果的影响。在其他情况下,VLCD不能很好地耐受。例如,12名患有局部晚期头颈癌的受试者中只有4人可以完成5周的VLCD干预,并且注意到了一些不良事件,包括2级恶心、3级疲劳、4级高尿酸血症和3级急性胰腺炎。VLCD在肺癌和胰腺癌患者中的耐受性也很差。例如,9名患有这些癌症的受试者中只有3名可以在2年内遵守饮食。头颈部、肺癌和胰腺癌患者有较高的恶病质发展风险,这可能会限制VLCD的适应能力。
使用VLCD作为抗癌干预的热情越来越高。碳水化合物和蛋白质含量较低、脂肪含量较高的饮食模式与胰腺癌患者的存活时间较长有关。然而,鉴于这些患者对减肥的高度偏好,目前尚不清楚这些患者是否能够耐受这种饮食模式。这个问题目前正在调查中。在乳腺癌患者中使用VLCD也有很好的数据。在一项对80名接受化疗的乳腺癌受试者进行的随机对照试验中,与标准饮食的对照组相比,为期12周的VLCD干预减少了肿瘤直径。我们谨慎解释这些结果,因为实体瘤反应评估标准(RECIST)未用于测量肿瘤大小,并且在某些亚组中,膳食脂肪摄入与乳腺癌发展和复发的风险增加有关。尽管如此,这些令人兴奋的初步数据支持了未来研究的需要,以更好地定义VLCD最能受益的特定患者亚群。
3.4 低脂饮食
LFD将脂肪摄入量限制在每天总热量的30%以下,并注意蔬菜、水果和全谷物的摄入量。LFD可以安全地促进未患癌症的受试者的体重减轻、脂肪减少、降低血液胆固醇和减少食物摄入。事实上,一些LFD得到了主要医学协会的认可,包括终止高血压膳食疗法(DASH)、美国农业部饮食模式、纯素饮食和美国心脏协会(AHA)饮食。
与本综述中讨论的其他饮食干预不同,LFD已在大量癌症受试者中进行了严格测试。妇女健康倡议饮食调整 (WHI DM) 试验是一项针对绝经后妇女的前瞻性随机对照研究,旨在检查LFD对乳腺癌、CRC和心血管疾病的长期益处和风险。虽然没有观察到癌症风险或总体死亡率的长期降低,但LFD干预降低了乳腺癌诊断后的死亡率。这一发现在两项随机试验中得到了更直接的评估:女性干预营养研究 (WINS) 和女性健康饮食和生活 (WHEL) 研究。两项都是随机试验,以测试 LFD 干预对先前治疗过的早期乳腺癌女性的影响。两项试验均在干预组和对照组之间实现了约9%的膳食脂肪摄入量减少,3年后退出率约为30%。尽管研究的人群和报告的结果存在一些显著差异,但WINS和WHEL数据表明LFD仅在乳腺癌患者亚组中具有有益作用。例如,在没有经历潮热的妇女中,饮食诱导的远端复发减少。这种益处可能是由于饮食能够降低雌二醇浓度,这可能与ER阻断年龄无关。这个问题目前正在调查中。
对于前列腺癌,LFD的好处尚不清楚。高脂肪和饱和脂肪的饮食会诱导MYC基因表达特征,该特征可独立预测前列腺癌的进展和死亡。这一发现导致研究人员在几个前列腺癌男性队列中研究LFD。尽管依从性良好,但在这种情况下,饮食不会改变血清前列腺特异性抗原、性激素、胰岛素或IGF1。肿瘤可以通过上调脂肪酸合成来逃避LFD的影响,因此通过将LFD与该途径的抑制剂结合可以提高临床疗效。
3.5 其他饮食干预
还有许多其他方法可以改变可能阻碍肿瘤生长的饮食。例如,特定氨基酸(如丝氨酸和甘氨酸、半胱氨酸和蛋氨酸)的消耗在临床前模型中显示出潜在的抗癌功效(在其他地方进行了很好的综述),但还没有临床数据。在临床前模型中限制这些氨基酸会耗尽肿瘤所需的一碳代谢前体,从而抑制肿瘤生长。此外,在饮食中添加某些糖、维生素和氨基酸可能会改变营养通量并增强抗癌治疗。许多这些方法的早期临床研究正在进行中。
4. 迈向癌症精准营养
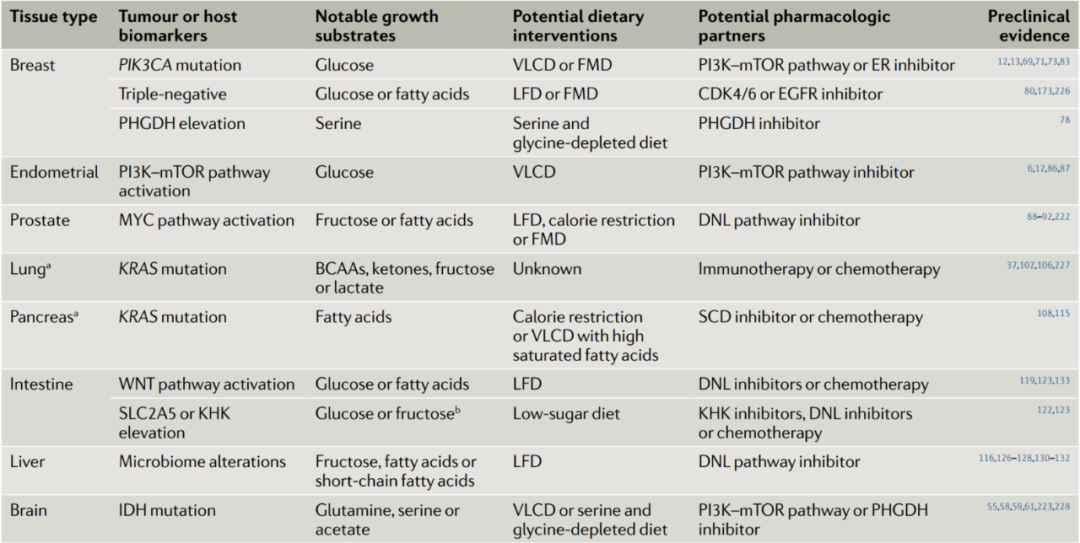
精准医疗承诺在正确的时间为正确的患者提供正确的药物。这种方法正在帮助将癌症治疗从一刀切转变为针对明确指出的癌症亚型的定制干预措施。类似的过程可以用于提供饮食干预以支持癌症治疗。我们建议针对具有独特组织学和分子特征的脆弱肿瘤组织类型进行针对性的饮食干预(表1)。例如,如上所述,ER+乳腺癌经常发生PIK3CA突变以逃避激素治疗。这些患者可能会受益于将激素和PI3K抑制剂治疗与VLCD相结合,从而降低胰岛素并降低肿瘤维持快速营养吸收的能力。相比之下,由于三阴性乳腺癌可能更依赖外源性脂肪酸,LFD可能是更好的干预措施。果糖和膳食脂肪可以促进结直肠癌的生长,因此不添加糖的植物性LFD(在人类中可行)可能适合这些患者。与此同时,胰腺癌细胞依赖于外源性不饱和脂肪酸,因此限制卡路里或特别富含饱和脂肪的VLCD可能是有效的。
饮食干预应与协同药物治疗相结合,因为仅靠饮食不太可能足以对抗肿瘤进展。例如,小鼠数据表明,当FMD和VLCD分别与CDK4/6和PI3K抑制剂配对时,它们可以导致持久的肿瘤消退。小鼠研究和人类基因组分析也支持将不含氨基酸的饮食和不饱和脂肪含量低的饮食分别与磷酸甘油酸脱氢酶(PHGDH)和SCD等代谢酶抑制剂相结合。卡路里限制和FMD与标准护理化疗协同作用的能力正在被积极研究中。
精准营养领域正在快速发展,许多预先注册的试验即将到来。我们想强调在计划对癌症患者进行饮食干预研究时需要考虑的几个方面(框3)。该领域需要更好地识别和分类与饮食相关的不良事件。所有有效的抗癌干预措施都会引起毒性,并且该领域需要就饮食干预可接受的毒性量达成一致。在最近发表的一项研究中,Vernieri等人预先指定了FMD引起的严重(3级或4级)不良事件的20%阈值。鉴于禁食可能有助于减轻化疗的副作用,这似乎是一个合理的临界值。即使有足够的安全性以及提供了足够的咨询和完整的菜单,一部分受试者也不遵守规定的饮食。这其中存在很多原因:在减肥过程中,神经激素通路可以显著调节行为,食物在我们的文化中具有情感价值,是在特殊场合与亲人联系的一种方式。如果在患有癌症的受试者中没有适当的先导数据,研究人员应在功效计算期间假设退出率为20-30%。因为有些饮食干预可能只对早期癌症患者有效,因此未来我们需要更多的研究来确定饮食干预的最佳开始时间,然而我们目前在这方面的信息有限。最后,关于饮食干预对人类肿瘤代谢、信号传导和免疫的影响,我们目前也知之甚少,这应该使用适当的药效学解释进行研究。
框3 癌症饮食干预研究的建议
·提供所有膳食以支持受试者的依从性。
结论
肿瘤组织起源和基因驱动突变导致了独特的代谢偏好,这可以通过癌症治疗期间的饮食来调节。大众媒体普遍认为健康饮食有助于对抗癌症。尽管这种观点得到了癌症预防方面的流行病学数据的支持,但是,抗击癌症是一项高风险、高回报的工作,可接受的毒性限度需要与取得成功结果的可能性相平衡。饮食干预研究的退出率相对较高,可能会产生额外的毒性;然而,有前景的临床前和早期临床数据支持它们的进一步发展。我们建议通过设计基于肿瘤组织起源、基因改变以及与全身激素和代谢物相互作用的程度来测试饮食-药物联合疗法的研究,从而最大限度地提高成功的可能性。未来的研究应该包括适当的药效学分析,列出每种饮食对肿瘤生长、代谢和微环境组成的影响,这些都是该领域的研究不足。
图文来源网络,版权属原作者并深表敬意,若转载涉及版权问题,请联系我们删除