
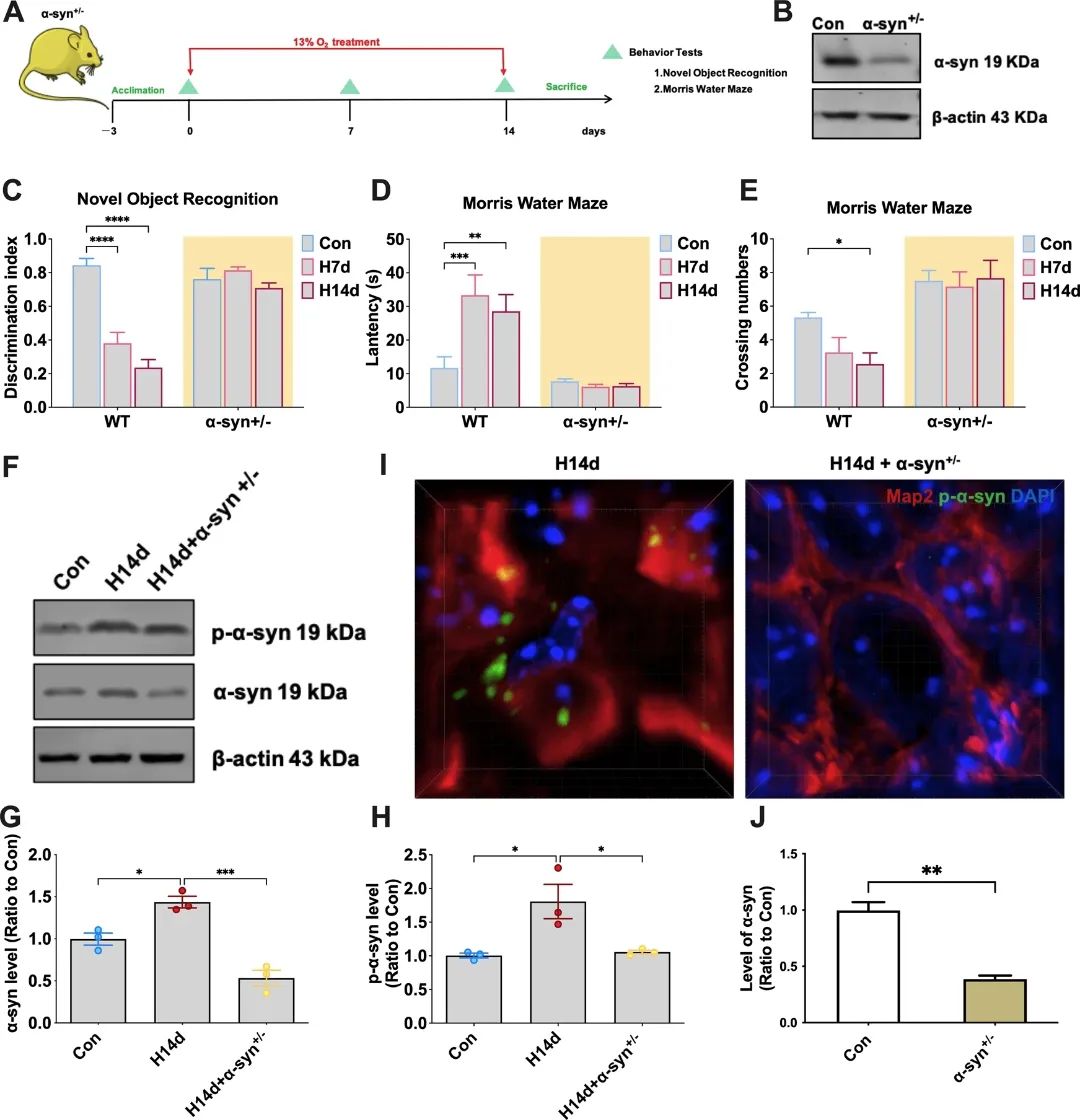
图2 α-syn基因敲除小鼠能够阻止慢性缺氧诱导的认知障碍。
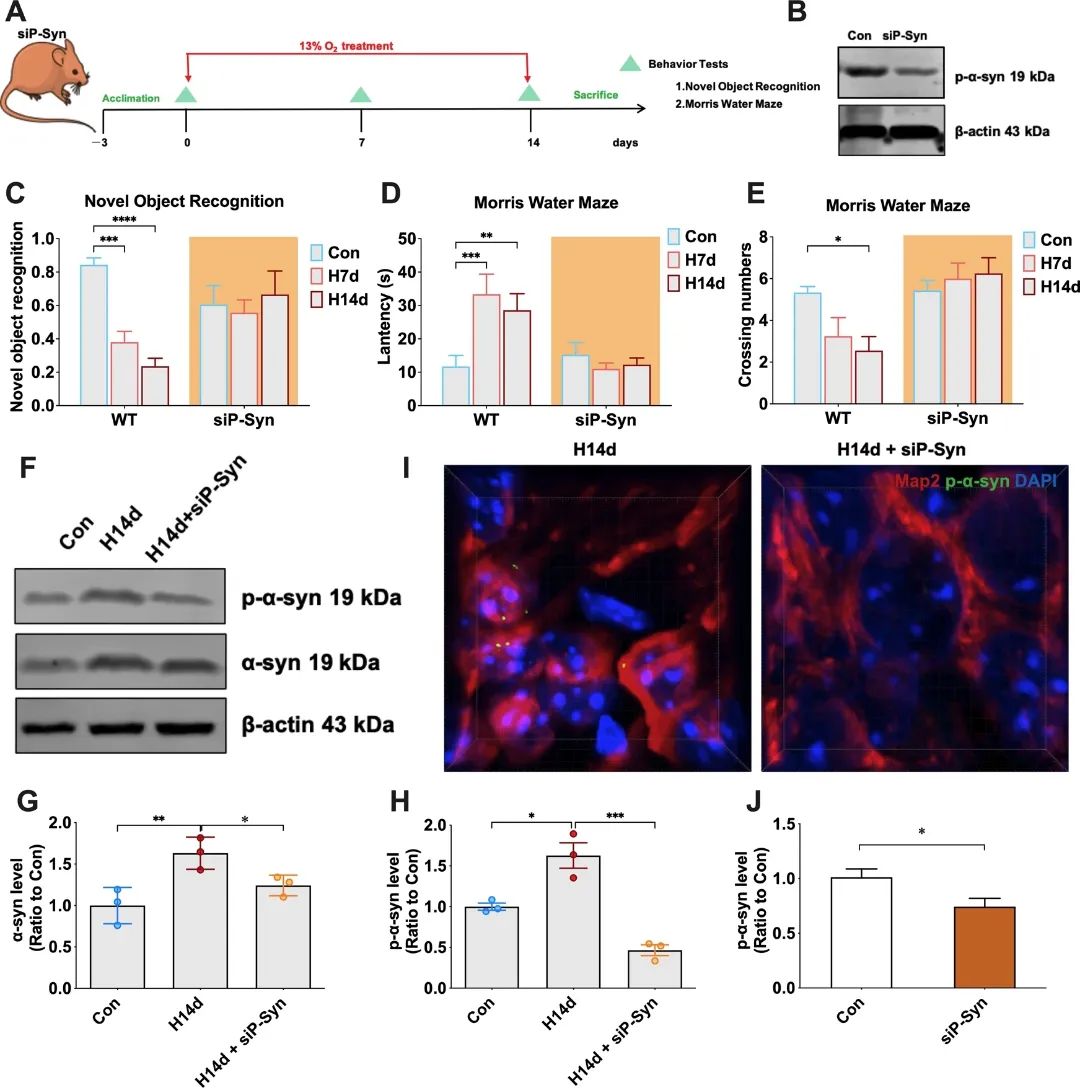
图3 α-syn S129竞争性肽处理可以抵抗慢性低氧诱导的小鼠认知障碍
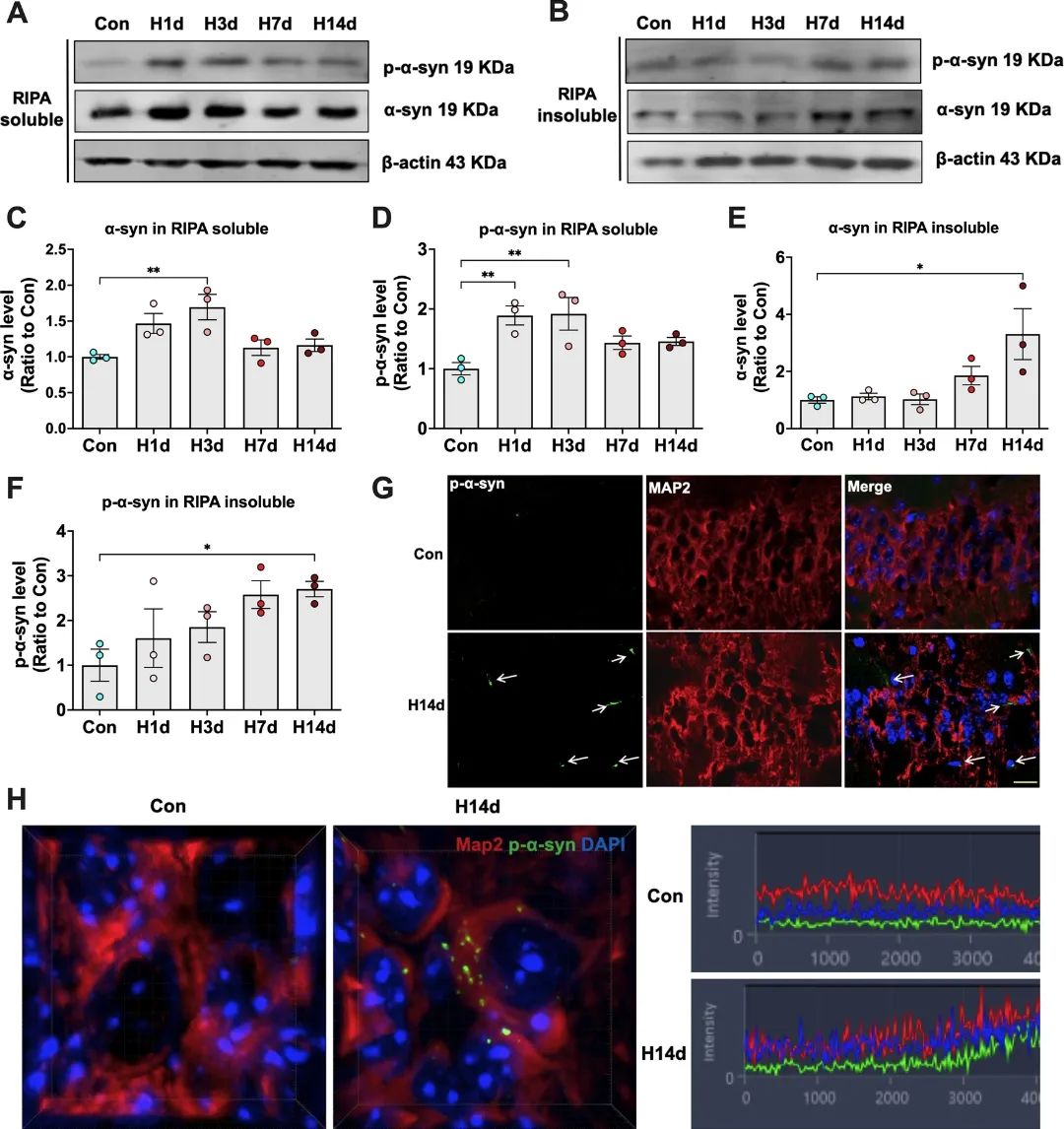
为了进一步探究慢性低氧诱导α-syn病理的分子机制,研究者进行了脂质组学检测,发现慢性低氧小鼠脑组织中神经酰胺各个亚型水平均显著降低,且其下游分子蛋白磷酸酶PP2A [12]活力也受到显著抑制。PP2A是α-syn的关键磷酸酶,其活性抑制会造成α-syn的过度磷酸化即病理性聚集[13]。为了探究慢性低氧造成脑中神经酰胺水平下降的原因,研究者聚焦到了神经酰胺的剪切酶,发现神经酰胺的重要剪切酶之一Acer2在低氧应激下的转录水平和蛋白水平均显著降低。前期研究显示低氧诱导因子(hypoxia-inducible factor,HIF)参与Acer2的转录调节[14],因此研究者进一步对HIF水平进行了检测,发现慢性低氧后大脑中HIF-2α(而非HIF-1α)入核增加,这是激活Acer2转录的主要因素。综上所述,研究者发现慢性低氧通过诱导HIF-2α入核,从而激活Acer2转录及神经酰胺降解,后者是诱发脑中α-syn病理和小鼠认知损伤的重要因素(图4)。
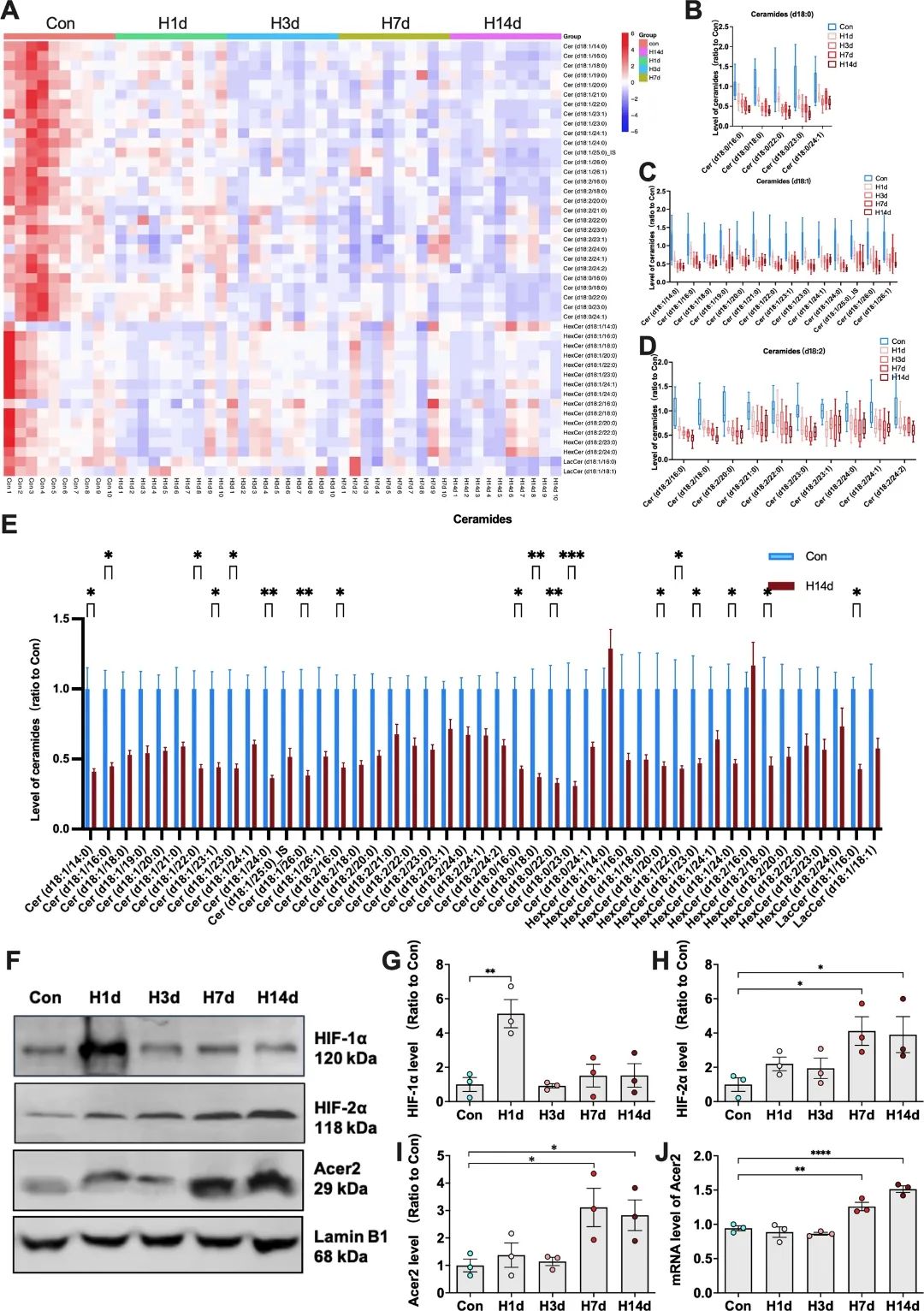
图4 慢性缺氧通过激活HIF-2α/Acer2信号通路促进神经酰胺水解代谢,从而下调PP2A活性。间歇性低氧预适应是提高机体低氧耐受力的重要途径,为了探究提高低氧耐受力是否可以抵抗慢性低氧诱导的α-syn病理和认知损伤,研究者对慢性低氧小鼠进行了间歇性低氧预适应。结果显示,经历间歇性低氧预适应的小鼠可以显著抵抗随后持续性低氧造成的认知损伤,并且阻断了慢性低氧小鼠脑中的α-syn的磷酸化和异常聚集,这为低氧相关认知损伤和α-syn相关疾病的干预提供了有效的手段和理论依据(图5)。

图5 间歇性缺氧预处理(IHPC)通过抑制α-syn磷酸化和聚集来缓解慢性缺氧诱导的小鼠认知障碍。
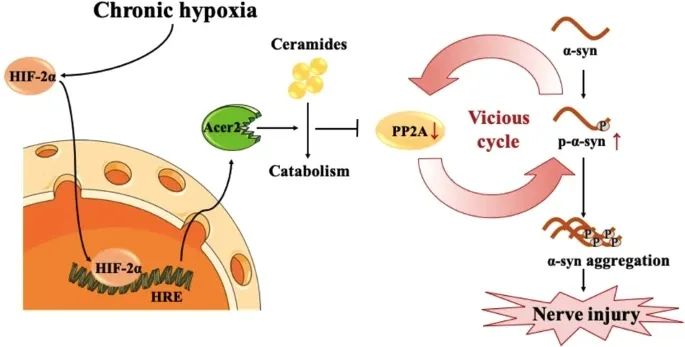 图6 慢性低氧通过HIF-2α依赖性途径激活Acer2转录进而调节神经酰胺代谢,最终特异性诱导α-syn病理及神经损伤的分子机制。
图6 慢性低氧通过HIF-2α依赖性途径激活Acer2转录进而调节神经酰胺代谢,最终特异性诱导α-syn病理及神经损伤的分子机制。正常成人的大脑约有1400克,占体质量的2%左右,但却需要全身血容量的20%。成年人脑组织每分钟约需要50~60 mL的氧气,为了维持这种不间断的需求,每分钟需要约750~1000 mL含有氧气的血流经过大脑,才能够提供维持正常功能活动所需的能量。在正常机体中,脑功能稳态依赖脑动脉和脑静脉功能的协调,任何原因引起的血流障碍都会导致急慢性脑功能障碍,其中动脉血流灌注不足,可引起缺血性缺氧,而脑静脉回流障碍,可引起淤血性缺氧。重要的是,脑动、静脉血管的急慢性病变导致的脑组织低血流性缺氧,是脑组织低氧损害的最常见原因,除急性卒中外,还可导致头痛、失眠、听力损害、记忆下降以及诱发和加重阿尔兹海默症、帕金森等神经退行性疾病。
此研究发现α-syn的过度磷酸化和聚集是慢性低氧诱导认知损伤的关键环节,敲除α-syn或干扰其磷酸化均可以抵抗慢性低氧诱导的认知损伤(图5)。该工作揭示了HIF-2α/Acer2信号通路所介导的神经酰胺代谢和PP2A活力抑制是慢性低氧诱导α-syn病理的关键分子机制(图5)。该工作还发现通过间歇性低氧的手段提高低氧耐受,可以显著抵抗慢性低氧诱导的α-syn病理和认知损伤,这为脑动脉急慢性闭塞以及脑静脉回流障碍所致的低氧相关性认知损害和α-syn相关疾病的干预提供了潜在思路(图5)。